組成式・分子式・イオン式のそれぞれの違いを解説していきます!
<そもそも化学式とはいったい何もの?>
化学式……物質の元素構成を元素記号で表したものです。
分子式や組成式は化学式の種類の一つと言えます。
勉強をはじめてすぐでは見慣れないため、中々わかりにくいと思います。
しかし、勉強を進め慣れてくると、非常に便利なものですので、ゆっくり慣れていきましょう。
⇒私の英語の偏差値が1か月で43から70に爆上がりしたワザはこちら
<分子式と組成式とは>
原子が特定の比率で結合した複合的な粒子を分子と言います。
分子式……分子を表した科学式のこと
例)水=水素原子2つと酸素原子1つが結合 → H2O
組成式……ダイヤモンドのような超巨大分子や、塩化ナトリウムのような分子がない物質を化学式で表すときには、元素の組成を最も簡単な整数比で表します。
例)ダイヤモンド → C
塩化ナトリウム → NaCl
つまり、分子式と組成式の違いは、
分子式は原子同士がくっついた小さなまとまりを表す化学式。
組成式は原子や分子同士が集まってできた集合体を表す化学式。
違いがわかりにくいですが、勉強をしながら身に着けてください。
⇒私の英語の偏差値が1か月で43から70に爆上がりしたワザはこちら
<イオン式とは>
イオン式……イオンを表す化学式のことです。
水素イオンや塩化物イオンなどをアルファベットと記号で表します。
例)水素イオン→H+
銅イオン→Cu2
右上の+と-で、陽イオンか陰イオンの区別をし、小さな数字は価数を表します。
<電子式とは>
化学式には、電子式と呼ばれるものもあります。
電子式……最外殻電子数を表した式のことです。
例)ヘリウム(最外殻電子数=2) He:
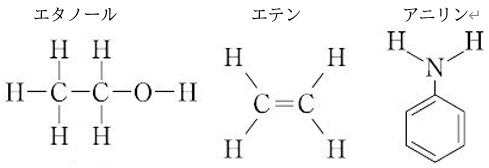
<構造式とは>
構造式……有機化合物を表す図のことで、見慣れれば便利になります。
詳しく説明すると、化合物の分子中における原子または原子団の結合関係を表す図のことです。
とくに有機化合物では一般に構成原子数が多く,かつ異性体をもつことが多いので,その構造の表示に構造式を多く用います。
一本線は単結合を、二重線は二重結合を表しています。
また、ベンゼン環は六角形の図形で表されており、学習を進めて見慣れていくうちに便利なものになってきますよ。
⇒私の英語の偏差値が1か月で43から70に爆上がりしたワザはこちら
<間違えがちな“グルコース”とは>
グルコース……分子式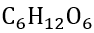 で表される糖の一種です。
で表される糖の一種です。
ブドウ糖とも呼ばれ、高校化学では度々登場します。
構造によって二種類のグルコースが作られますが、この二種類のグルコースをよく見間違えることがあります。構造式をしっかりと見極めてミスを減らすことを意識しましょう。
各構造式の右端を注目してください。
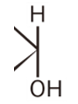
上に水素、下にヒドロキシ基
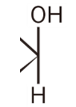
上にヒドロキシ基、下に水素
各構造式でこの箇所が非常に微妙ですが、逆転した構造になっています。これが、グルコースの種類を変えています。
α―グルコース
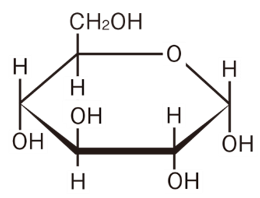
ヒドロキシ基が下につくグルコースを「α―グルコース」と呼びます。
β―グルコース
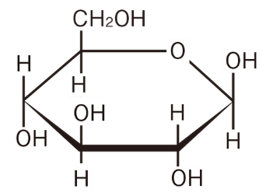
ヒドロキシ基が上につくグルコースを「β―グルコース」と呼びます。
非常に細かい違いですが、これらが多数の結合を作ると大きな違いが生まれます。
見分け方をしっかりと覚えておきましょう。
⇒私の英語の偏差値が1か月で43から70に爆上がりしたワザはこちら
<組成式・分子式・イオン式の違いまとめ>
今回は、組成式・分子式・イオン式の違いを中心に解説をしました。
勉強したての頃には、覚えたり、見分けることが大変だと思いますが、しっかりと勉強をして使いこなせるようにしてください!



